|
高中化学基础知识整理
Ⅰ、基本概念与基础理论:
一、阿伏加德罗定律
1.内容:在同温同压下,同体积的气体含有相同的分子数。即“三同”定“一同”。
2.推论
(1)同温同压下,V1/V2=n1/n2 同温同压下,M1/M2=ρ1/ρ2
注意:①阿伏加德罗定律也适用于不反应的混合气体。②使用气态方程PV=nRT有助于理解上述推论。
3、阿伏加德罗常这类题的解法:
①状况条件:考查气体时经常给非标准状况如常温常压下,1.01×105Pa、25℃时等。
②物质状态:考查气体摩尔体积时,常用在标准状况下非气态的物质来迷惑考生,如H2O、SO3、已烷、辛烷、CHCl3等。
③物质结构和晶体结构:考查一定物质的量的物质中含有多少微粒(分子、原子、电子、质子、中子等)时常涉及希有气体He、Ne等为单原子组成和胶体粒子,Cl2、N2、O2、H2为双原子分子等。晶体结构:P4、金刚石、石墨、二氧化硅等结构。
二、离子共存
1.由于发生复分解反应,离子不能大量共存。
(1)有气体产生。如CO32-、SO32-、S2-、HCO3-、HSO3-、HS-等易挥发的弱酸的酸根与H+不能大量共存。
(2)有沉淀生成。如Ba2+、Ca2+、Mg2+、Ag+等不能与SO42-、CO32-等大量共存;Mg2+、Fe2+、Ag+、Al3+、Zn2+、Cu2+、Fe3+等不能与OH-大量共存;Fe2+与S2-、Ca2+与PO43-、Ag+与I-不能大量共存。
(3)有弱电解质生成。如OH-、CH3COO-、PO43-、HPO42-、H2PO4-、F-、ClO-、AlO2-、SiO32-、CN-、C17H35COO-、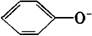 等与H+不能大量共存;一些酸式弱酸根如HCO3-、HPO42-、HS-、H2PO4-、HSO3-不能与OH-大量共存;NH4+与OH-不能大量共存。 等与H+不能大量共存;一些酸式弱酸根如HCO3-、HPO42-、HS-、H2PO4-、HSO3-不能与OH-大量共存;NH4+与OH-不能大量共存。
(4)一些容易发生水解的离子,在溶液中的存在是有条件的。如AlO2-、S2-、CO32-、C6H5O-等必须在碱性条件下才能在溶液中存在;如Fe3+、Al3+等必须在酸性条件下才能在溶液中存在。这两类离子不能同时存在在同一溶液中,即离子间能发生“双水解”反应。如3AlO2-+Al3++6H2O=4Al(OH)3↓等。
2.由于发生氧化还原反应,离子不能大量共存。
(1)具有较强还原性的离子不能与具有较强氧化性的离子大量共存。如S2-、HS-、SO32-、I-和Fe3+不能大量共存。
(2)在酸性或碱性的介质中由于发生氧化还原反应而不能大量共存。如MnO4-、Cr2O7-、NO3-、ClO-与S2-、HS-、SO32-、HSO3-、I-、Fe2+等不能大量共存;SO32-和S2-在碱性条件下可以共存,但在酸性条件下则由于发生2S2-+SO32-+6H+=3S↓+3H2O反应不能共在。H+与S2O32-不能大量共存。
3.能水解的阳离子跟能水解的阴离子在水溶液中不能大量共存(双水解)。
例:Al3+和HCO3-、CO32-、HS-、S2-、AlO2-、ClO-等;Fe3+与CO32-、HCO3-、AlO2-、ClO-等不能大量共存。
4.溶液中能发生络合反应的离子不能大量共存。
如Fe2+、Fe3+与SCN-不能大量共存;Fe3+与 不能大量共存。 不能大量共存。
5、审题时应注意题中给出的附加条件。
①酸性溶液(H+)、碱性溶液(OH-)、能在加入铝粉后放出可燃气体的溶液、由水电离出的H+或OH-=1×10-10mol/L的溶液等。
②有色离子MnO4-,Fe3+,Fe2+,Cu2+,Fe(SCN)2+。
③MnO4-,NO3-等在酸性条件下具有强氧化性。
④S2O32-在酸性条件下发生氧化还原反应:S2O32-+2H+=S↓+SO2↑+H2O
⑤注意题目要求“大量共存”还是“不能大量共存”。
6、审题时还应特别注意以下几点:
(1)注意溶液的酸性对离子间发生氧化还原反应的影响。如:Fe2+与NO3-能共存,但在强酸性条件下(即Fe2+、NO3-、H+相遇)不能共存;MnO4-与Cl-在强酸性条件下也不能共存;S2-与SO32-在钠、钾盐时可共存,但在酸性条件下则不能共存。
(2)酸式盐的含氢弱酸根离子不能与强碱(OH-)、强酸(H+)共存。
如HCO3-+OH-=CO32-+H2O(HCO3-遇碱时进一步电离);HCO3-+H+=CO2↑+H2O
三、氧化性、还原性强弱的判断
 (1)根据元素的化合价 (1)根据元素的化合价
物质中元素具有最高价,该元素只有氧化性;物质中元素具有最低价,该元素只有还原性;物质中元素具有中间价,该元素既有氧化性又有还原性。对于同一种元素,价态越高,其氧化性就越强;价态越低,其还原性就越强。
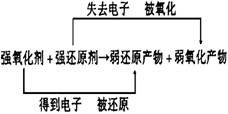
(2)根据氧化还原反应方程式
在同一氧化还原反应中,氧化性:氧化剂>氧化产物
还原性:还原剂>还原产物
氧化剂的氧化性越强,则其对应的还原产物的还原性就越弱;还原剂的还原性越强,则其对应的氧化产物的氧化性就越弱。
(3)根据反应的难易程度
注意:①氧化还原性的强弱只与该原子得失电子的难易程度有关,而与得失电子数目的多少无关。得电子能力越强,其氧化性就越强;失电子能力越强,其还原性就越强。
②同一元素相邻价态间不发生氧化还原反应。
四、比较金属性强弱的依据
金属性:金属气态原子失去电子能力的性质;
金属活动性:水溶液中,金属原子失去电子能力的性质。
注:金属性与金属活动性并非同一概念,两者有时表现为不一致,
1、同周期中,从左向右,随着核电荷数的增加,金属性减弱;
同主族中,由上到下,随着核电荷数的增加,金属性增强;
2、依据最高价氧化物的水化物碱性的强弱;碱性愈强,其元素的金属性也愈强;
3、依据金属活动性顺序表(极少数例外);
4、常温下与酸反应煌剧烈程度;5、常温下与水反应的剧烈程度;
6、与盐溶液之间的置换反应;7、高温下与金属氧化物间的置换反应。
五、比较非金属性强弱的依据
1、同周期中,从左到右,随核电荷数的增加,非金属性增强;
同主族中,由上到下,随核电荷数的增加,非金属性减弱;
2、依据最高价氧化物的水化物酸性的强弱:酸性愈强,其元素的非金属性也愈强;
3、依据其气态氢化物的稳定性:稳定性愈强,非金属性愈强;
4、与氢气化合的条件;5、与盐溶液之间的置换反应;
6、其他,例:2Cu+SCu2S Cu+Cl2CuCl2 所以,Cl的非金属性强于S。
六、“10电子”、“18电子”的微粒小结
(一)“10电子”的微粒:
|
|
分子 |
离子 |
|
一核10电子的 |
Ne |
N3−、O2−、F−、Na+、Mg2+、Al3+ |
|
二核10电子的 |
HF |
OH−、 |
|
三核10电子的 |
H2O |
NH2− |
|
四核10电子的 |
NH3 |
H3O+ |
|
五核10电子的 |
CH4 |
NH4+ |
(二)“18电子”的微粒
|
|
分子 |
离子 |
|
一核18电子的 |
Ar |
K+、Ca2+、Cl‾、S2− |
|
二核18电子的 |
F2、HCl |
HS− |
|
三核18电子的 |
H2S |
|
|
四核18电子的 |
PH3、H2O2 |
|
|
五核18电子的 |
SiH4、CH3F |
|
|
六核18电子的 |
N2H4、CH3OH |
|
注:其它诸如C2H6、N2H5+、N2H62+等亦为18电子的微粒。
七、微粒半径的比较:
1、判断的依据 电子层数: 相同条件下,电子层越多,半径越大。
核电荷数 相同条件下,核电荷数越多,半径越小。
最外层电子数 相同条件下,最外层电子数越多,半径越大。
2、具体规律:1、同周期元素的原子半径随核电荷数的增大而减小(稀有气体除外)如:Na>Mg>Al>Si>P>S>Cl.
2、同主族元素的原子半径随核电荷数的增大而增大。如:Li
3、同主族元素的离子半径随核电荷数的增大而增大。如:F--------
4、电子层结构相同的离子半径随核电荷数的增大而减小。如:F-> Na+>Mg2+>Al3+
5、同一元素不同价态的微粒半径,价态越高离子半径越小。如Fe>Fe2+>Fe3+
八、物质溶沸点的比较
(1)不同类晶体:一般情况下,原子晶体>离子晶体>分子晶体
(2)同种类型晶体:构成晶体质点间的作用大,则熔沸点高,反之则小。
①离子晶体:离子所带的电荷数越高,离子半径越小,则其熔沸点就越高。
②分子晶体:对于同类分子晶体,式量越大,则熔沸点越高。HF、H2O、NH3等物质分子间存在氢键。
③原子晶体:键长越小、键能越大,则熔沸点越高。
(3)常温常压下状态
①熔点:固态物质>液态物质
②沸点:液态物质>气态物质
九、分子间作用力及分子极性
 定义:把分子聚集在一起的作用力 定义:把分子聚集在一起的作用力
 分子间作用力(范德瓦尔斯力):影响因素:大小与相对分子质量有关。 分子间作用力(范德瓦尔斯力):影响因素:大小与相对分子质量有关。
作用:对物质的熔点、沸点等有影响。
 ①、定义:分子之间的一种比较强的相互作用。 ①、定义:分子之间的一种比较强的相互作用。
分子间相互作用 ②、形成条件:第二周期的吸引电子能力强的N、O、F与H之间(NH3、H2O)
③、对物质性质的影响:使物质熔沸点升高。
④、氢键的形成及表示方式:F-—H···F-—H···F-—H···←代表氢键。
    氢键 O O 氢键 O O
  H H H H H H H H
  O O
H H
⑤、说明:氢键是一种分子间静电作用;它比化学键弱得多,但比分子间作用力稍强;是一种较强的分子间作用力。
 定义:从整个分子看,分子里电荷分布是对称的(正负电荷中心能重合)的分子。 定义:从整个分子看,分子里电荷分布是对称的(正负电荷中心能重合)的分子。
  非极性分子 双原子分子:只含非极性键的双原子分子如:O2、H2、Cl2等。 非极性分子 双原子分子:只含非极性键的双原子分子如:O2、H2、Cl2等。
 举例: 只含非极性键的多原子分子如:O3、P4等 举例: 只含非极性键的多原子分子如:O3、P4等
分子极性 多原子分子: 含极性键的多原子分子若几何结构对称则为非极性分子
如:CO2、CS2(直线型)、CH4、CCl4(正四面体型)
 极性分子: 定义:从整个分子看,分子里电荷分布是不对称的(正负电荷中心不能重合)的。 极性分子: 定义:从整个分子看,分子里电荷分布是不对称的(正负电荷中心不能重合)的。
 举例 双原子分子:含极性键的双原子分子如:HCl、NO、CO等 举例 双原子分子:含极性键的双原子分子如:HCl、NO、CO等
 多原子分子: 含极性键的多原子分子若几何结构不对称则为极性分子 多原子分子: 含极性键的多原子分子若几何结构不对称则为极性分子
如:NH3(三角锥型)、H2O(折线型或V型)、H2O2
十、化学反应的能量变化
 定义:在化学反应过程中放出或吸收的热量; 定义:在化学反应过程中放出或吸收的热量;
符号:△H
单位:一般采用KJ·mol-1
测量:可用量热计测量
研究对象:一定压强下在敞开容器中发生的反应所放出或吸收的热量。
 反应热: 表示方法:放热反应△H<0,用“-”表示;吸热反应△H>0,用“+”表示。 反应热: 表示方法:放热反应△H<0,用“-”表示;吸热反应△H>0,用“+”表示。
燃烧热:在101KPa下,1mol物质完全燃烧生成稳定氧化物时所放出的热量。
 定义:在稀溶液中,酸跟碱发生反应生成1molH2O时的反应热。 定义:在稀溶液中,酸跟碱发生反应生成1molH2O时的反应热。
中和热:强酸和强碱反应的中和热:H+(aq)+OH-(aq)=H2O(l); △H=-57.3KJ·mol-
弱酸弱碱电离要消耗能量,中和热 |△H|<57.3KJ·mol-1
 原理:断键吸热,成键放热。 原理:断键吸热,成键放热。
 反应热的微观解释:反应热=生成物分子形成时释放的总能量-反应物分子断裂时所吸收的总能量 反应热的微观解释:反应热=生成物分子形成时释放的总能量-反应物分子断裂时所吸收的总能量
 定义:表明所放出或吸收热量的化学方程式。 定义:表明所放出或吸收热量的化学方程式。
意义:既表明化学反应中的物质变化,也表明了化学反应中的能量变化。
 热化学 ①、要注明反应的温度和压强,若反应是在298K,1atm可不注明; 热化学 ①、要注明反应的温度和压强,若反应是在298K,1atm可不注明;
方程式 ②、要注明反应物和生成物的聚集状态或晶型;
书写方法 ③、△H与方程式计量数有关,注意方程式与△H对应,△H以KJ·mol-1单位,化学计量数可以是整数或分数。
④、在所写化学反应方程式后写下△H的“+”或“-”数值和单位,方程式与△H之间用“;”分开。
盖斯定律:一定条件下,某化学反应无论是一步完成还是分几步完成,反应的总热效应相同。
十一、影响化学反应速率的因素及其影响结果
内因:反应物的性质
外因 浓度↗ v↗ 压强↗ v↗(气体)
温度↗ v↗ 催化剂 v↗(正催化剂)
其它(光,超声波,激光,放射线,电磁波,反应物颗粒大小,扩散速率,溶剂等)
十二、影响化学平衡的的条件:
(1)浓度:在其它条件不变的情况下,增大反应物的浓度或减小生成物的浓度,平衡向正反应方向移动;反之向逆反应方向移动;
(2)压强:在其它条件不变的情况下,增大压强会使平衡向气体体积缩小的方向移动;减小压强平衡向气体体积增大的方向移动;注意:①对于气体体积相同的反应来说,增减压强平衡不移动; ②若平衡混合物都是固体或液体,增减压强平衡也不移动; ③压强变化必须改变了浓度才有可能使平衡移动.
(3)温度:在其它条件下,升高温度平衡向吸热方向移动;降低温度平衡向放热方向移动.(温度改变时,平衡一般都要移动)注意:催化剂同等倍数加快或减慢正逆反应的速率,故加入催化剂不影响平衡,但可缩短达到平衡的时间.
十三、勒沙特列原理(平衡移动原理)
如果改变影响平衡的一个条件(浓度,温度,压强等)平衡就向减弱这种改变的方向移动.
十四、充入稀有气体对化学平衡的影响:
(1)恒压下通稀有气体,平衡移动方向相当于直接减压(也同于稀释对溶液中反应的影响);
 (2)恒容下通稀有气体,平衡不移动. 注意:只要与平衡混合物的物质不反应的气体都可称”稀有”气体 (2)恒容下通稀有气体,平衡不移动. 注意:只要与平衡混合物的物质不反应的气体都可称”稀有”气体
Ⅱ、元素及其化合物
1、各种“水”汇集
(一)纯净物:重水D2O;超重水T2O;蒸馏水H2O;双氧水H2O2;水银Hg; 水晶SiO2。
(二)混合物:氨水(分子:NH3、H2O、NH3·H2O;离子:NH4+、OH‾、H+)
氯水(分子:Cl2、H2O、HClO;离子:H+、Cl‾、ClO‾、OH‾)
苏打水(Na2CO3的溶液) 生理盐水(0.9%的NaCl溶液)
水玻璃(Na2SiO3水溶液) 卤水(MgCl2、NaCl及少量MgSO4)
水泥(2CaO·SiO2、3CaO·SiO2、3CaO·Al2O3) 王水(由浓HNO3和浓盐酸以1∶3的体积比配制成的混合物)
2、各种“气”汇集
(一)无机的:爆鸣气(H2与O2); 水煤气或煤气(CO与H2);碳酸气(CO2)
(二)有机的:天然气(又叫沼气、坑气,主要成分为CH4)
液化石油气(以丙烷、丁烷为主) 裂解气(以CH2=CH2为主) 焦炉气(H2、CH4等)
电石气(CH≡CH,常含有H2S、PH3等)
3、具有漂白作用的物质
|
氧化作用 |
化合作用 |
吸附作用 |
|
Cl2、O3、Na2O2、浓HNO3 |
SO2 |
活性炭 |
|
化学变化 |
物理变化 |
|
不可逆 |
可逆 |
※其中能氧化指示剂而使指示剂褪色的主要有Cl2(HClO)和浓HNO3及Na2O2
4、能升华的物质
I2、干冰(固态CO2)、升华硫、红磷,萘。(蒽和苯甲酸作一般了解)。
5、Fe3+的颜色变化
1、向FeCl3溶液中加几滴KSCN溶液呈红色;
2、FeCl3溶液与NaOH溶液反应,生成红褐色沉淀;
3、向FeCl3溶液溶液中通入H2S气体,生成淡黄色沉淀;
4、向FeCl3溶液中加入几滴Na2S溶液,生成淡黄色沉淀;
当加入的Na2S溶液过量时,又生成黑色沉淀;
5、向FeCl3溶液中加入过量Fe粉时,溶液变浅绿色;
6、向FeCl3溶液中加入过量Cu粉,溶液变蓝绿色;
7、将FeCl3溶液滴入淀粉KI溶液中,溶液变蓝色;
8、向FeCl3溶液中滴入苯酚溶液,溶液变紫色
6、“置换反应”有哪些?
1、较活泼金属单质与不活泼金属阳离子间置换
如:Zn+Cu2+==Zn2++Cu Cu+2Ag+=2Ag
2、活泼非金属单质与不活泼非金属阴离子间置换
Cl2+2Br‾==2Cl‾+Br2 I2+S2−==2I‾+S 2F2+2H2O==4HF+O2
3、活泼金属与弱氧化性酸中H+置换
2Al+6H+==2Al3−+3H2↑ Zn+2CH3COOH==Zn2++2CH3COO‾+H2↑
4、金属单质与其它化合物间置换
2Mg+CO22MgO+C 2Mg+SO22 MgO+S
2Na+2H2O==2Na++2OH‾+H2↑
2Na+2C6H5OH(熔融)→2C6H5ONa+H2↑
2Na+2C2H5OH→2C2H5ONa+H2↑
10Al+3V2O55Al2O3+6V 8Al+3Fe3O44 Al2O3+9Fe
2FeBr2+3Cl2==2FeCl3+2Br2 2 FeI2+3Br2==2FeBr3+2I2
Mg+2H2OMg(OH)2+H2↑ 3Fe+4H2O(气)Fe3O4+4 H2↑
5、非金属单质与其它化合物间置换
H2S+X2==S↓+2H++2X‾ 2H2S+O2(不足)2S+2H2O
CuO+CCu+CO↑ CuO+H2Cu+H2O SiO2+2CSi+2CO↑
3Cl2+8NH3==6NH4Cl+N2
3Cl2+2NH3==6HCl+N2
7、条件不同,生成物则不同
1、2P+3Cl22PCl3(Cl2不足) ;2P+5Cl22 PCl5(Cl2充足)
2、2H2S+3O22H2O+2SO2(O2充足) ;2H2S+O22H2O+2S(O2不充足)
3、4Na+O22Na2O 2Na+O2Na2O2
4、Ca(OH)2+CO2CaCO3↓+H2O ;Ca(OH)2+2CO2(过量)==Ca(HCO3)2↓
5、2Cl2+2 Ca(OH)2==Ca(ClO)2+CaCl2+2H2O
6Cl2+6 Ca(OH)2Ca(ClO3)2+5CaCl2+6H2O
6、C+O2CO2(O2充足) ;2 C+O22CO (O2不充足)
7、8HNO3(稀)+3Cu==2NO↑+2Cu(NO3)2+4H2O
4HNO3(浓)+Cu==2NO2↑+Cu(NO3)2+2H2O
10、AlCl3+3NaOH==Al(OH)3↓+3NaCl ;
AlCl3+4NaOH(过量)==NaAlO2+2H2O
11、NaAlO2+4HCl(过量)==NaCl+2H2O+AlCl3
NaAlO2+HCl+H2O==NaCl+Al(OH)3↓
12、Fe+6HNO3(热、浓)==Fe(NO3)3+3NO2↑+3H2O
Fe+HNO3(冷、浓)→(钝化)
13、Fe+6HNO3(热、浓)Fe(NO3)3+3NO2↑+3H2O
Fe+4HNO3(热、浓)Fe(NO3)2+2NO2↑+2H2O
14、Fe+4HNO3(稀)Fe(NO3)3+NO↑+2H2O
3Fe+8HNO3(稀) 3Fe(NO3)3+2NO↑+4H2O
15、C2H5OH CH2=CH2↑+H2O CH2=CH2↑+H2O
C2H5-OH+HO-C2H5 C2H5-O-C2H5+H2O C2H5-O-C2H5+H2O
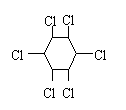 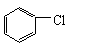 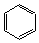 16、 +Cl2 +HCl 16、 +Cl2 +HCl
 +3Cl2 (六氯环已烷) +3Cl2 (六氯环已烷)
17、C2H5Cl+NaOH C2H5OH+NaCl
C2H5Cl+NaOHCH2=CH2↑+NaCl+H2O
18、6FeBr2+3Cl2(不足)==4FeBr3+2FeCl3
2FeBr2+3Cl2(过量)==2Br2+2FeCl3
8、滴加顺序不同,现象不同
1、AgNO3与NH3·H2O:
AgNO3向NH3·H2O中滴加——开始无白色沉淀,后产生白色沉淀
NH3·H2O向AgNO3中滴加——开始有白色沉淀,后白色沉淀消失
2、Ca(OH)2与H3PO4(多元弱酸与强碱反应均有此情况):
Ca(OH)2向H3PO4中滴加——开始无白色沉淀,后产生白色沉淀
H3PO4向Ca(OH)2中滴加——开始有白色沉淀,后白色沉淀消失
3、NaOH与AlCl3:
NaOH向AlCl3中滴加——开始有白色沉淀,后白色沉淀消失
AlCl3向NaOH中滴加——开始无白色沉淀,后产生白色沉淀
4、HCl与NaAlO2:
HCl向NaAlO2中滴加——开始有白色沉淀,后白色沉淀消失
NaAlO2向HCl中滴加——开始无白色沉淀,后产生白色沉淀
5、Na2CO3与盐酸:
Na2CO3向盐酸中滴加——开始有气泡,后不产生气泡
盐酸向Na2CO3中滴加——开始无气泡,后产生气泡
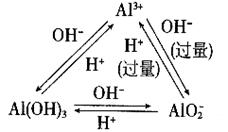 9、常用反应 9、常用反应
Al3+ + 4OH- = AlO2- +2H2O
3AlO2- + Al3+ + 6H2O = 4 Al (OH)3
2CO2 + 2Na2O2 = 2Na2CO3 + O2 △m = 56g
2H2O + 2Na2O2 = 4NaOH + O2 △m = 4g
 AlO2- + CO2 + 2H2O = Al (OH)3↓+ HCO3- AlO2- + CO2 + 2H2O = Al (OH)3↓+ HCO3-
2NaCl + MnO2 + 3H2SO4 2NaHSO4 + MnSO4 + Cl2↑+ 2H2O
10、特殊反应
2F2 + 2H2O = 4HF + O2
Si +2NaOH + H2O = Na2SiO3 + 2H2↑
2Al + 2NaOH + 2H2O = 2NaAlO2 + 3H2↑
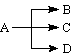 二、 (A:NaHCO3、(NH4)2CO3、NH4HCO3、NaCl (aq) ) 二、 (A:NaHCO3、(NH4)2CO3、NH4HCO3、NaCl (aq) )
A ↓(白)+ ↑(无色) (A:CaC2、Al2S3、Mg3N2)
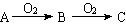 (A:S、H2S、N2、Na、醇) (A:S、H2S、N2、Na、醇)
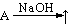 (A:铵盐、Al、Si、CH3COONa) (A:铵盐、Al、Si、CH3COONa)
 (A:氯化物) (A:氯化物)
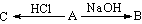 (A:Al、(NH4)2CO3、NH4HCO3、NaHCO3、NaHS、(NH4)2S、NH4HS、氨基酸) (A:Al、(NH4)2CO3、NH4HCO3、NaHCO3、NaHS、(NH4)2S、NH4HS、氨基酸)
中学化学常见气体单质:H2、O2、N2、Cl2、(F2)
固体单质:S、Na、Mg、Al、Fe、Cu
液体单质:Br2
中学化学常见化合物:NaCl、NaOH、Na2CO3、NaHCO3、FeCl2、FeCl3、H2SO4、
HCl、CaCO3、SO2、H2O、NO、NO2、HNO3
化学工业
|
制备的物质 |
反应原理 |
设备 |
|
|
分离液态空气 |
|
|
|
|
|
|
漂白粉和漂粉精 |
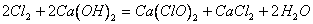
|
|
|
玻璃 |
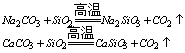
|
玻璃熔炉 |
|
合成氨 |

|
合成塔 |
|
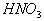
|

|
氧化炉、吸收塔 |
|
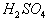
|

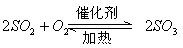
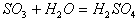
|
沸腾炉、接触室、吸收塔 |
|
炼铁 |

|
高炉 |
|
氯碱工业 |
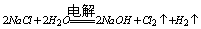
|
电解槽 |
|
炼铝 |
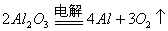
|
电解槽 |
|
精炼铜 |
阳极
阴极 |
|
|
电镀铜 |
阳极
阴极 |
|
Ⅲ、有机化学
最简式相同的有机物
1. CH:C2H2和C6H6
2. CH2:烯烃和环烷烃
3. CH2O:甲醛、乙酸、甲酸甲酯
4. CnH2nO:饱和一元醛(或饱和一元酮)与二倍于其碳原子数和饱和一元羧酸或酯;举一例:乙醛(C2H4O)与丁酸及其异构体(C4H8O2)
同分异构体
1、醇——醚 CnH2n+2Ox
2、醛—酮—环氧烷(环醚) CnH2nO
3、羧酸—酯—羟基醛 CnH2nO2
4、氨基酸—硝基烷
能发生取代反应的物质及反应条件
1. 烷烃与卤素单质:卤素蒸汽、光照;
2. 苯及苯的同系物与①卤素单质:Fe作催化剂;
②浓硝酸:50~60℃水浴;浓硫酸作催化剂
③浓硫酸:70~80℃水浴;
3. 卤代烃水解:NaOH的水溶液;
4. 醇与氢卤酸的反应:新制的氢卤酸;
5. 酯类的水解:无机酸或碱催化;
6. 酚与浓溴水或浓硝酸
(乙醇与浓硫酸在140℃时的脱水反应,事实上也是取代反应。)
能发生加成反应的物质
1. 烯烃的加成:卤素、H2、卤化氢、水
2. 炔烃的加成:卤素、H2、卤化氢、水
3. 二烯烃的加成:卤素、H2、卤化氢、水
4. 苯及苯的同系物的加成:H2、Cl2
5. 苯乙烯的加成:H2、卤化氢、水、卤素单质
6. 不饱和烃的衍生物的加成:(包括卤代烯烃、卤代炔烃、烯醇、烯醛、烯酸、烯酸酯、烯酸盐等)
7. 含醛基的化合物的加成:H2、HCN等
8. 酮类物质的加成:H2
9. 油酸、油酸盐、油酸某酯、油(不饱和高级脂肪酸甘油酯)的加成。
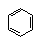 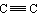 能与氢气加成的: 、C=C、 、C=O 能与氢气加成的: 、C=C、 、C=O
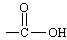 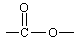
( 和 中的C=O双键不发生加成)
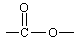 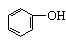
能与NaOH反应的:—COOH、 、 、
能发生加聚反应的物质
烯烃、二烯烃、乙炔、苯乙烯、烯烃和二烯烃的衍生物。
能发生缩聚反应的物质
1. 苯酚和甲醛:浓盐酸作催化剂、水浴加热
2. 二元醇和二元羧酸等
缩合聚合(简称缩聚):单体之间通过脱去小分子(如H2O等)生成高分子的反应。例如:
能发生银镜反应的物质
凡是分子中有醛基(-CHO)的物质均能发生银镜反应。
1. 所有的醛(R-CHO);
2. 甲酸、甲酸盐、甲酸某酯;
注:能和新制Cu(OH)2反应的——除以上物质外,还有酸性较强的酸(如甲酸、乙酸、丙酸、盐酸、硫酸、氢氟酸等),发生中和反应。
能与溴水反应而使溴水褪色或变色的物质
(一)有机
1. 不饱和烃(烯烃、炔烃、二烯烃、苯乙烯等);
2. 不饱和烃的衍生物(烯醇、烯醛、油酸、油酸盐、油酸某酯、油等)
3. 石油产品(裂化气、裂解气、裂化汽油等);
4. 苯酚及其同系物(因为能与溴水取代而生成三溴酚类沉淀)
5. 含醛基的化合物
6. 天然橡胶(聚异戊二烯)
(二)无机
1. -2价硫(H2S及硫化物);
2. +4价硫(SO2、H2SO3及亚硫酸盐);
3. +2价铁:
 6FeSO4+3Br2=2Fe2(SO4)3+2FeBr3 6FeSO4+3Br2=2Fe2(SO4)3+2FeBr3
6FeCl2+3Br2=4FeCl3+2FeBr3 变色
2FeI2+3Br2=2FeBr3+2I2
4.Zn、Mg等单质 如Mg+Br2MgBr2
(此外,其中亦有Mg与H+、Mg与HbrO的反应)
5.-1价的碘(氢碘酸及碘化物) 变色
6.NaOH等强碱:Br2+2OH‾==Br‾+BrO‾+H2O
7.Na2CO3等盐:Br2+H2O==HBr+HBrO
2HBr+Na2CO3==2NaBr+CO2↑+H2O
HBrO+Na2CO3==NaBrO+NaHCO3
8.AgNO3
能萃取溴而使溴水褪色的物质
上层变无色的(ρ>1):卤代烃(CCl4、氯仿、溴苯等)、CS2;
下层变无色的(ρ<1):直馏汽油、煤焦油、苯及苯的同系物、液态环烷烃、低级酯、液态饱和烃(如已烷等)等
能使酸性高锰酸钾溶液褪色的物质
(一)有机
1. 不饱和烃(烯烃、炔烃、二烯烃、苯乙烯等);
2. 苯的同系物;※
3. 不饱和烃的衍生物(烯醇、烯醛、烯酸、卤代烃、油酸、油酸盐、油酸酯等);
4. 含醛基的有机物(醛、甲酸、甲酸盐、甲酸某酯等);
5. 酚类
6. 石油产品(裂解气、裂化气、裂化汽油等);
7. 煤产品(煤焦油);
8. 天然橡胶(聚异戊二烯)。
(二)无机
1. 氢卤酸及卤化物(氢溴酸、氢碘酸、浓盐酸、溴化物、碘化物);
2. 亚铁盐及氢氧化亚铁;
3. -2价硫的化合物(H2S、氢硫酸、硫化物);
4. +4价硫的化合物(SO2、H2SO3及亚硫酸盐);
5. 双氧水(H2O2,其中氧为-1价)
※注:苯的同系物被KMnO4(H+)溶液氧化的规律:
侧链上与苯环直接相连的碳原子被氧化成羧基,其他碳原子则被氧化成CO2。
倘若侧链中与苯环直接相连的碳原子上没有氢,则不能被氧化。
如:
,
Ⅳ、化学实验:
不宜长期暴露空气中的物质
1.由于空气中CO2的作用:
生石灰、NaOH、Ca(OH)2溶液、Ba(OH)2溶液、NaAlO2溶液、水玻璃、碱石灰、漂白粉、苯酚钠溶液、Na2O、Na2O2;
2.由于空气中H2O的作用:
浓H2SO4、P2O5、硅胶、CaCl2、碱石灰等干燥剂、浓H3PO4、无水硫酸铜、CaC2、面碱、NaOH固体、生石灰;
3.由于空气中O2的氧化作用:
钠、钾、白磷和红磷、NO、天然橡胶、苯酚、-2价硫(氢硫酸或硫化物水溶液)、+4价硫(SO2水溶液或亚硫酸盐)、亚铁盐溶液、Fe(OH)2。
4.由于挥发或自身分解作用:
AgNO3、浓HNO3、H2O2、液溴、浓氨水、浓HCl、Cu(OH)2。
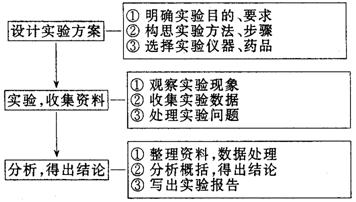 化学实验设计思维模型: 化学实验设计思维模型:
实验中水的妙用
一、水封:在中学化学实验中,白磷、液溴需要水封,少量白磷放入盛有冷水的广口瓶中保存,通过水的覆盖,既可隔绝空气防止白磷蒸气逸出,又可使其保持在燃点之下;液溴极易 挥发有剧毒,它在水中溶解度较小,比水重,所以亦可进行水封减少其挥发。
二、水浴:酚醛树脂的制备、纤维素的水解需用沸水浴;硝基苯的制备(50—60℃)、乙酸乙
酯的水解(70~80℃)、硝酸钾溶解度的测定(室温~100℃)需用温度计来控制温度;银镜反应需用温水浴加热即可。
三、水集:排水集气法可以收集难溶或不溶于水的气体,中学阶段有02,N:,H2,C2H4, C2H2,CH4,NO。有些气体在水中有一定溶解度,但可以在水中加入某物质降低其溶解度,如:可用排饱和食盐水法收集氯气。
四、水洗:用水洗的方法可除去某些难溶气体中的易溶杂质,如除去NO气体中的N02杂质。
五、物质鉴别剂:可利用一些物质在水中溶解度或密度的不同进行物质鉴别,如:苯、乙醇 溴乙烷三瓶未有标签的无色液体,用水鉴别时浮在水上的是苯,溶在水中的是乙 醇,沉于水下的是溴乙烷。
六、查漏:气体发生装置连好后,可用水检查其是否漏气。
Ⅴ、化学计算
(一)有关化学式的计算
1.通过化学式,根据组成物质的各元素的原子量,直接计算分子量。
2.已知标准状况下气体的密度,求气体的式量:M=22.4ρ。
3.根据相对密度求式量:M=MˊD。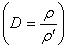
4.由气态方程求式量:M=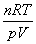
5.混合物的平均分子量:
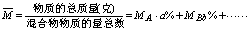
6.原子量
①原子的原子量=
②质量数=质子数+中子数
③元素原子量: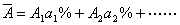
A1、A2表示同位素原子量,a1%、a2%表示原子的摩尔分数
④元素近似原子量: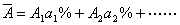
A1、A2表示同位素原子量,a1%、a2%表示原子的摩尔分数
②对气体使用体积时注意条件(温度及压强),否则气体体积无意义
(二) 溶液计算
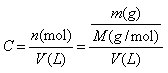 基本公式及关系: 基本公式及关系:
(1)物质的量浓度:
①。
②稀释过程中溶质不变:C1V1=C2V2。
③同溶质的稀溶液相互混合:C混=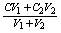
④质量分数换算为物质的量浓度:C=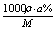
(2)溶质的质量分数。
①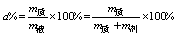
②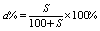 (饱和溶液,S代表溶质该条件下的溶解度) (饱和溶液,S代表溶质该条件下的溶解度)
③混合:m1a1%+m2a2%=(m1+m2)a%混
④稀释:m1a1%=m2a2%
(3)有关溶解度的计算:
①S=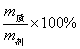 (饱和溶液:一定温度下) (饱和溶液:一定温度下)
②S=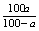 (a%:饱和溶液质量分数) (a%:饱和溶液质量分数)
③有关pH值的计算:酸算H+,碱算OH—
Ⅰ. pH= —lg[H+]
Ⅱ. KW=[H+][OH-]=10-14(25℃下)
考试注意:
1. 要抓住关键字在题目的问题中,通常出现如下词:正确与错误、大与小、强与弱、能与否,由强到弱或由弱到强,名称与符号,分子式、结构简式、电子式,化学方程式与离子方程式等,即使题目会做,由于不注意上述词语,就有可能造成失分。
2. 注意各量的单位物质的量浓度(mol/L),摩尔质量(g/mol),深解度(g)、百分数、浓度互换时的体积易错等。
3. 题目中隐含性的限制条件如(1)酸性的无色透明溶液,(2)PH=0的溶液(3)水电离出的[OH-]=10-14mol/L的溶液等
4. 注意常见符号的应用如"=",可逆符号、"△H>0"、"△H<0"、沉淀、气体符号,电荷与价标、写电子式时"[ ]"的应用、物质的聚集状态、特殊的反应条件等等。 实验填空题或简答题,注意文字要准确(1)不要用错别字:如脂与酯、铵与氨、坩与甘、蘸与粘、蓝与兰、褪与退、溶与熔、戊与戌、催与崔、苯与笨等。(2) 不用俗语:如a、打开分液漏斗的开关(活塞),b、将气体通进(入)盛溴水的洗气瓶,c、酸遇石蕊变红色(酸使石蕊呈红色)等。 |

